Hinweise für Einsender
Eine Bearbeitung und Begutachtung von Proben ist nur möglich, wenn dem eingesandten Material ein Untersuchungsauftrag beigefügt ist.
Der Untersuchungsauftrag muss folgende Angaben enthalten:
- Name und Anschrift des Auftraggebers
- Name und Geburtsdatum des Patienten, ggf. Patientennummer
- Kostenträger
- kurze Anamnese
- Fragestellung
- Beschreibung des Materials (Entnahmeort, Art des Materials)
Externe und interne Einsender bitten wir, die hier unter 1. und 2. hinterlegten Formulare zu benutzen.
UKE-interne Einsendungen können nur mit einer zusätzlichen SOARIAN-Neuropathologie-Anforderung bearbeitet werden.
Hinweise zur sachgerechten Proben-Asservierung finden Sie in den Merkblättern Muskelbiopsie , Nervenbiopsie und Hautbiopsie.
Bei Prozessen, die auch im Knochen lokalisiert sind, prüft der diensthabende Arzt, ob eine Weiterleitung des Materials an die Osteopathologie des Instituts für Pathologie, UKE, notwendig ist.
In einzelnen Fällen wird vom Institut für Neuropathologie selbständig ein Konsil von einem Referenzzentrum erbeten. Der Einsender wird im Begutachtungsbericht über die Konsilanforderung und das ausgewählte Referenzzentrum informiert. Sofern Einsender oder Patient der Konsilanforderung nicht widersprechen, stimmen sie der Datenweitergabe an das Referenzzentrum zu.
Annahmestelle für Ihre Einsendungen ist die zentrale Probenannahme des Diagnostikzentrums in Haus O26, 1.Obergeschoss, Raum 109-1, UKE.
Die Annahmezeiten für unfixiertes Material sind Mo.-Do. 8:00-16:00 Uhr und Fr. 8:00-15:30 Uhr.
Mobiltelefon des diensthabenden Arztes INTERN (9)25751, EXTERN 01522281-7702
Referenzzentren
Referenzzentrum für Liquordiagnostik der HIT Studie Einsender benutzen bitte dieses Formular
Referenzneuropathologie für Ependymome der SIOP Ependymoma II-Studie. Bitte verwenden Sie dieses Formular
Hypophysentumorregister der Deutschen Gesellschaft für Endokrinologie
Referenzzentrum für Prionerkrankungen (PRZ) der Deutschen Gesellschaft für Neuropathologie und Neuroanatomie (DGNN)
Das Institut für Neuropathologie des UKE ist das Referenzzentrum für Prionerkrankungen (PRZ) der Deutschen Gesellschaft für Neuropathologie und Neuroanatomie (DGNN)
Prionerkrankungen (z.B. die Creutzfeldt-Jakob Erkrankung beim Menschen) sind progressive neurodegenerative Krankheiten welche sporadisch (d.h. spontan ohne jegliche erkennbare Ursache), familiär (genetisch/vererbt, mit Mutationen in dem Gen welches für das Prionprotein kodiert) oder erworben (als übertragene Erkrankung) auftreten können. Diese Krankheiten sind selten mit einer durchschnittlichen Inzidenz (d.h. neu diagnostizierte Patienten/Jahr) von ca. zwei Fällen per Millionen. Eine Therapie existiert nicht.
Aufgaben des Referenzzentrums für Prionerkrankungen am UKE
-Konsiliarische Begutachtung von Gehirnen oder Biopsaten mit der Frage einer Prionerkrankung (Merkblatt zur Einsendung von Probenmaterial; Merkblatt zur Durchführung einer Sektion bei V.a. eine Prionerkrankung).
-Unterstützung wissenschaftlicher Projekte.
-Weiterbildung im Bereich der Prionerkrankungen.
-Beratung hinsichtlich Infektionsschutz und Dekontaminationsmaßnahmen bei Prionerkrankungen oder Verdachtsfällen einer Prionerkrankung (siehe Empfehlungen des Robert Koch-Institutes (RKI) zur Inaktivierung und Entfernung von Prionen bei der Aufbereitung von Medizinprodukten 2004; siehe Empfehlungen des Center for Disease Control (CDC) zum Umgang mit Prionen).
-Aktivitäten in der Qualitätssicherung im Bereich der Diagnostik von Prionerkrankung.
Molekularpathologische Diagnostik
Material
Molekularpathologische Analysen werden im Institut für Neuropathologie routinemäßig an Nukleinsäuren aus Formalin-fixiertem, Paraffin-eingebetteten (FFPE) Gewebe durchgeführt. Es können aber auch gefrorenes Gewebe oder Liquorproben zur Nukleinsäureextraktion verwendet werden.
Bei Verwendung von FFPE-Gewebe benötigen wir entweder einen Paraffinblock oder ein aktuelles HE-gefärbtes Schnittpräparat plus 10 Leerschnitte à 10 μm Dicke (für FISH-Analysen ein HE gefärbtes Schnittpräparat plus 2 Leerschnitte à 2 µm). Bei Verwendung von Liquorproben bitten wir um mindestens 5 ml nativen Liquor binnen 24 Stunden nach Entnahme, oder um mindestens 5 ml Liquorüberstand. Details hierzu sind dem entsprechenden Einsendeschein zu entnehmen. Bei Einsendung von gefrorenem Gewebe oder DNA bitten wir um vorherige Rücksprache.
Für ambulante Patienten können molekularpathologische Analysen bei Übersendung eines Überweisungsscheins durchgeführt werden.
Untersuchungen
Das Institut für Neuropathologie bietet folgende molekularpathologische Einzel-Untersuchungen an:
▪ Globale DNA-Methylierungsanalyse (EPIC-Analyse, „850k“/“935k“-Analyse; s. auch "Epigenomics Core Facility")
▪ Panel-Sequenzierung
▪ Nanopore Sequenzierung
▪ Fluoreszenz in situ Hybridisierungen (FISH): 1p/19q, C19MC, MYB, MYBL1, MYC, MYCN, MN1, RELA, ZFTA (C11orf95)
▪ Sanger-Sequenzierungen: Mutations-Hotspots der Gene IDH1 (R132), IDH2 (R172) und BRAF (V600), sowie des TERT-Promoters (C228T und C250T)
▪ Fusionsanalysen mittels RT-PCR:
KIAA1549-BRAF (Ex. 15-9, 16-9 und 16-11; Hasselblatt M et al., Neuropathol. Appl. Neurobiol. 2011)
ZFTA-RELA (Fusionstypen 1-4 nach Parker M et al., Nature 2014)
▪ Pyrosequenzierung zur Ermittlung des MGMT-Promoter-Methylierungsstatus
1. Globale DNA-Methylierungsanalyse (EPIC-Analyse, „850k“-Analyse)
DNA Methylierung ist ein Mechanismus der Genregulation. Cytosin-Basen der DNA können vor allem in den Promoterregionen der Gene methyliert werden. Dies führt dazu, dass das nachfolgende Gen nicht mehr abgelesen wird. Da in verschiedenen Tumoren unterschiedliche Gene aktiv sind, unterscheiden sich verschiedene Tumore auch im Methylierungsprofil, d.h. darin, welche Cytosin-Basen methyliert und welche unmethyliert sind. In verschiedenen Tumoren einer Entität ist das DNA Methylierungsprofil hingegen sehr ähnlich, und kann daher für diagnostische Zwecke genutzt werden.
Unter Nutzung von Illumina EPIC BeadChips können wir den Methylierungsstatus von 935.000 („935k“) Methylierungsstellen individueller Tumore gleichzeitig erfassen. Eine nachfolgende Analyse des DNA Methylierungsprofils mit verschiedenen Classifiern des Deutschen Krebsforschungszentrums kann zur Tumorklassifikation genutzt werden. Für die Analyse mit dem sogenannten Hirntumorclassifier (Capper D et al., Nature 2021) wird das genomweite DNA Methylierungsprofil eines Tumors beispielsweise mit dem von über 2800 Tumoren abgeglichen, die zu >100 Referenzklassen von Hirntumoren und Normalgewebe gehören. Der kalibrierte Classifier Score (zwischen 0 und 1) drückt die Ähnlichkeit mit einer Referenzklasse aus. Darüber hinaus sind Analysen mit dem Meningeomclassifier (Sahm F et al., Lancet Oncology 2017), dem Medulloblastomclassifier (Sharma T et al., Acta Neuropathol. 2019) und dem Sarkomclassifier (Koelsche C et al., Acta Neuropathol. Comm. 2020) möglich. So können die DNA Methylierungsdaten zur Tumorklassifizierung genutzt werden.
Aus den DNA Methylierungsdaten wird gleichzeitig auch der MGMT-Promoter-Methylierungsstatus bestimmt (Bady P et al., Acta Neuropathol. 2012). Dieser kann genutzt werden, um prädiktiv abzuschätzen, wie gut ein Tumor voraussichtlich auf eine Chemotherapie mit Temozolomid ansprechen wird (Hegi ME et al., NEJM 2005).
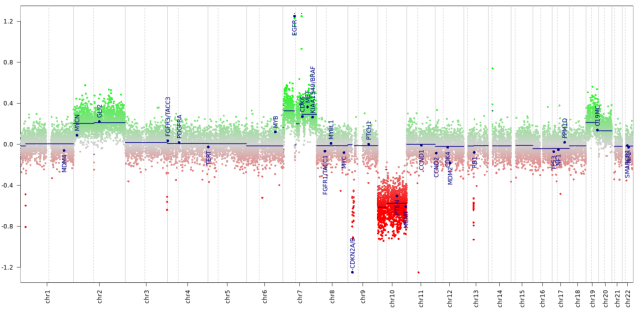
Darüber hinaus wird aus den DNA Methylierungsdaten ein Kopienzahlprofil berechnet. Aus dem Kopienzahlprofil lassen sich strukturelle chromosomale Veränderungen ablesen. So erkennt man partielle oder komplette chromosomale Zugewinne und Verluste, Amplifikationen und fokale Deletionen. Manche Veränderungen wie ein Zugewinn von Chromosom 7 und ein Verlust von Chromosom 10 (+7/-10) bei Glioblastomen (s. Abbildung) können als diagnostische Kriterien genutzt werden (Brat DJ et al., Acta Neuropathol. 2018). Andere Veränderungen wie eine homozygote CDKN2A/B-Deletion bei IDH-mutierten Astrozytomen haben prognostische Bedeutung (Shirahata M et al., Acta Neuropathol. 2018).
Ein aus DNA Methylierungsdaten berechnetes Kopienzahlprofil eines IDH-Wildtyp Glioblastoms zeigt unter anderem einen typischen Zugewinn von Chromosom 7 und Verlust von Chromosom 10 (+7/-10), eine EGFR-Amplifikation und eine homozygote Deletion des CDKN2A/B Lokus.
Auch manche Genfusionen gehen mit bestimmten Kopienzahlveränderungen einher. Ein Beispiel hierfür ist ein fokaler Zugewinn auf 7q34 bei Vorliegen einer KIAA1549-BRAF Fusion (Stichel D. et al., Neuropathol. Appl. Neurobiol. 2021). Diese Genfusionen sind teils Zielstrukturen zielgerichteter Therapien.
Aus den DNA Methylierungsanalysen lassen sich in Summe diagnostisch, therapeutisch, prognostisch und prädiktiv relevante Informationen gewinnen.
2. DNA Panel-Sequenzierung
Mit weiterentwickelten Sequenziertechniken, dem sogenannten „next-generation sequencing“ (NGS), können im Gegensatz zu der Sanger-Sequenzierung zahlreiche Gene parallel sequenziert und verschiedene Mutationen gleichzeitig ermittelt werden. Darüber hinaus erlaubt die Technik eine Quantifizierung des Verhältnisses von mutiertem Allel zum Wildtyp-Allel. Hieraus kann ein Rückschluss auf den Prozentsatz von Tumorzellen im Gewebe gezogen werden. Die Sensitivität des NGS ist sehr hoch, so dass Mutationen auch bei vergleichsweise geringem Tumorzellgehalt detektiert werden können.
NGS-Analysen können das ganze Genom, Exom oder definierte Genbereiche abdecken. Eine Panel-Sequenzierung bezeichnet eine NGS-Analyse bei der bestimmte, vorher festgelegte Gene oder Genbereiche sequenziert werden.
Die mittels NGS detektierten Mutationen können diagnostisch,prognostisch und/oder therapeutisch/prädiktiv relevant sein.
3. Nanopore Sequenzierungen
Hierbei handelt es sich um eine Sequenziertechnik der dritten Generation, die prinzipiell genomweit durchgeführt wird. Sie erfasst bei ausreichender Sequenziertiefe auch verlässlich auswertbare Sequenzvarianten, wird von uns aber im Wesentlichen für ein sog. shallow sequencing verwendet. Aus den entstehenden Daten könnten genomweite Kopienzahlprofile und DNA Methylierungsmuster ausgelesen werden, die diagnostisch oder prognostisch relevante Marker bestimmen können (z.B. Amplifikationen bei MYC oder Deletion bei CDKN2A/B) bzw. zur Tumorklassifikation herangezogen werden. Die Auswertung erfolgt hierbei prinzipiell ähnlich wie bei den globalen Methylierungsanalysen über EPIC arrays (siehe oben). Ein wesentlicher Vorteil der Nanoporesequenzierungen ist neben der kurzen turn-around time die Möglicheit, mit sehr geringen DNA Mengen zu arbeiten, was z.B. die Analyse zellfreier DNA in Liquorüberständen zulässt (siehe auch Afflerbach et al 2024, Clin Chem 70(1):250-260).
Epigenomics core facility
Die in 2017 etablierte Core facility des UKE für Epigenetik am Institut für Neuropathologie bietet die Analyse von Proben mittels Illumina arrays oder Nanopore Sequenzierungen an. Die von der Firma Illumina entwickelte Technologie, bei der mit muriner oder humaner DNA hybridisierte chips durch ein iScan Gerät ausgelesen werden, macht es möglich, bis zu 935000 definierte Cytosine innerhalb des Genoms auf ihre Methylierung zu überprüfen. Die Methodik findet breite Anwendung bei der Erforschung epigenetischer Grundlagen von Krankheitsprozessen, ist aber vor allem in der Onkologie von prominenter Bedeutung, seit bekannt wurde, dass biologisch und klinisch voneinander unterscheidbare Tumorentitäten distinkte Methylierungsprofile aufweisen, die mithilfe von künstlicher Intelligenz auch zur Klassifikation von Tumoren genutzt werden können (siehe z.B. Capper et al. 2018, Nature 555(7697) :469-474. Auch bei der Nanopore Sequenzierung, die deutlich schneller durchgeführt werden kann, aber bislang nicht für in Paraffin eingebettetes Gewebe geeignet ist, können Methylierungsmuster ausgelesen werden. Beide Technologien lassen zeitgleich zur Analyse des Methyloms auch die Berechnung von Kopienzahlprofilen zu, sodass chromosomale Zugewinne oder Verluste sowie Amplifikationen oder Deletionen einer DNA erkannt werden können.
Die Core facility hat seit ihrer Etablierung am UKE tausende Proben für Kooperationspartner am UKE, aber auch für nationale und internationale Partner prozessiert. Neben der Analyse von Forschungsproben bieten wir auch für die bioinformatische Prozessierung und die Auswertung der Daten unsere Hilfe an.
Die Bearbeitungszeit beträgt ca. 2 Wochen.
Anfragen und Proben können jederzeit entgegengenommen werden. Für die Analysen, die in O38 (2. Stock, Institut für Neuropathologie) laufen, wird genomische DNA oder Gewebe bzw. Zellen zur Extraktion von DNA benötigt.
Kontakt
Prof. Dr. med. Ulrich Schüller Fachliche Leitung, [email protected] oder Nicole Borgardt Technische Leitung, [email protected]