Unsere Arbeitsgruppen
-
AG Klinische Studien
AG Klinische Studien
Prof. Dr. med. Rainer Böger, Dr. Juliane Hannemann
Forschung
Die klinische Erforschung von Wirkstoffen ist ein zentrales Aufgabengebiet der Klinischen Pharmakologie. In der Arbeitsgruppe werden Studienprotokolle entwickelt, klinische Studien durchgeführt und ausgewertet. Dabei handelt es sich in aller Regel um sogenannte „Investigator-initiated Trials“ (IIT), also Studien, die nicht im Auftrag der pharmazeutischen Industrie, sondern unabhängig und in Trägerschaft des UKE durchgeführt werden. Ein Beispiel ist die Erforschung der Wirkungen von Melatonin auf den Tag-Nacht-Rhythmus bei Schichtarbeitern, eine Studie im Rahmen des EU-geförderten Projekts EuRhythDia. Auch für die Qualitätssicherung anderer IIT-Studien, die im UKE durchgeführt werden, übernimmt die Arbeitsgruppe im Auftrag des Dekanats wichtige Aufgaben.
-
AG Molekulare Mechanismen chronischer Erkrankungen
AG Molekulare Mechanismen chronischer Erkrankungen
Dr. Juliane Hannemann, Prof. Dr. med. Rainer Böger
Forschung
Das Auftreten chronischer Erkrankungen im fortschreitenden Lebensalter ist ein wesentlicher Faktor für die Begrenzung der Lebenserwartung in Westeuropa. Erkrankungen des Herz- Kreislaufsystems, Erkrankungen der Lunge, Stoffwechselerkrankungen, chronisch-degenerative Erkrankungen verschiedener Organsysteme sowie Krebserkrankungen machen einen großen Anteil der Mortalitätsursachen aus. Dabei liegen vielen dieser Erkrankungen gleiche oder ähnliche Pathomechanismen zugrunde; chronische Entzündungsprozesse, die Entgleisung von adaptativen oder kompensatorischen Mechanismen der physiologischen Regulation und molekulargenetische Veränderungen sind Beispiele hierfür.
Die Arbeitsgruppe beschäftigt sich mit der Identifikation solcher molekularer Pathomechanismen und versucht hieraus neue Ansatzpunkte für die Erkennung, die Prävention und Therapie chronischer Erkrankungen zu entwickeln. Beispiele sind u.a. die Auswirkungen von Störungen der circadianen Regulation auf den Glucosestoffwechsel (EU-Projekt EuRhythDia) und die Auswirkungen von Hypoxie auf die endotheliale Regulation der Kreislaufhomöostase (BMBF-Projekt DECIPHER).
Wissenschaftler: Dr. Juliane Hannemann, Prof. Dr. Rainer Böger
Bei Interesse an einer experimentellen Doktorarbeit in dieser Arbeitsgruppe nehmen Sie gern Kontakt mit uns auf unter [email protected] oder 040-7410-59701.
-
AG Biomarker und vasoaktive Botenstoffe
AG Biomarker und vasoaktive Botenstoffe
Prof. Dr. rer. nat. Edzard Schwedhelm
Forschung
- Biomarker für kardiovaskuläre Erkrankungen
- Vasoaktive Botenstoffe und pharmakologische Intervention
- Argininstoffwechsel als therapeutisches Target
Das Zusammenspiel verschiedener Botenstoffe ist für die Funktionalität und Integrität des Gefäßsystems von zentraler Bedeutung. Neben Vasokonstriktoren wie Katecholaminen, Endothelin-1 und Angiotensin-2, sind dies u.a. Sphingosin-1-Phosphat (S1P), Prostaglandine und Isoprostane. Das Sphingolipid S1P ist an der Regulation physiopathologischer Prozesse wie Atherosklerose und Intimahyperplasie beteiligt. Unsere Arbeitsgruppe untersucht, welche S1P Rezeptoren involviert sind, und ob eine pharmakologische Inhibierung bzw. Aktivierung einzelner S1P Rezeptoren die Progression der Atherosklerose oder die Entstehung restenotischer Läsionen beeinflussen kann.
Der wichtigste Vasodilatator des Gefäßsystems ist das im vaskulären Endothel aus Arginin gebildete Stickstoffmonoxid (NO). Endogene Arginin-Derivate, darunter asymmetrisches Dimethylarginin (ADMA) und symmetrisches Dimethylarginin (SDMA) hemmen die NO-Biosynthese. Untersuchungen unserer Arbeitsgruppe zeigen, dass es in der Dimethylarginin-Dimethylaminohydrolase (DDAH)-defizienten Maus, in der ADMA nicht mehr metabolisiert werden kann, zu einer Erhöhung des Blutdrucks und endothelialer Dysfunktion kommt. Im Gegensatz zu den Dimethylargininen zeigt die natürlich vorkommende Aminosäure Homoarginin protektive Eigenschaften bei kardiovaskulären Erkrankungen. L-Arginin:Glycin-Amidinotransferase (AGAT)-defiziente Mäuse, denen das für die Homoarginin-Synthese verantwortliche Enzym fehlt, zeigen verschiedene kardiovaskuläre Phänotypen, die durch Homoarginin-Supplementation verbessert werden können.
Ein Schwerpunkt unserer Arbeitsgruppe sind pharmakologische und metabolische Untersuchungen mit massenspektrometrischen Techniken sowohl im Tiermodell als auch in klinischen Proben. Dazu wurde 2012 die Shared Expertise "Cardometrics" des Deutschen Zentrums für Herz-Kreislauf-Forschung e.V. (DZHK) gegründet, die zielgerichtete Untersuchungen von Metaboliten in Blutplasma und Gewebeproben anbietet.
Eine aktuelle Übersicht unserer Publikationen finden Sie hier
-
AG Pharmakologie für Pharmazeuten
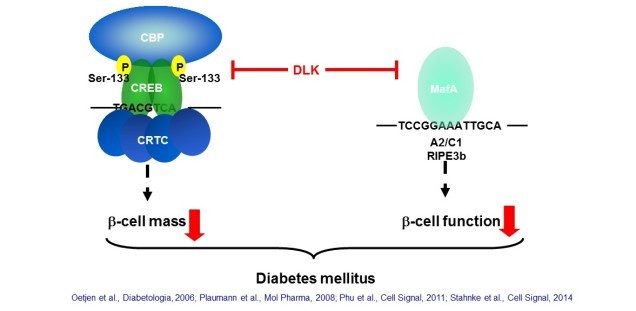
Diabetes mellitus und DLK
Prof. Dr. med. Elke Oetjen
Forschung
Molekulare Pathogenese des Diabetes mellitus Typ 2 und seiner Komplikationen
Diabetes mellitus gehört zu den weltweit am stärksten zunehmenden Erkrankungen. Mikro- und makrovaskuläre Komplikationen mit Erkrankungen des kardiovaskulären Systems zählen zu den Folgeerkrankungen von Diabetes. Neben der peripheren Insulinresistenz führt der Verlust der Funktion und der Masse der Insulin produzierenden pankreatischen beta-Zellen zu Diabetes Typ 2. Unsere eigenen Untersuchungen zeigen, dass die dual leucine zipper kinase (DLK) beta-Zellapoptose und damit beta-Zellverlust induziert und die Insulinsekretion und –biosynthese als wichtige Funktionen der beta-Zelle hemmt. Wir untersuchen jetzt die Rolle der DLK für die Entstehung von Diabetes und dessen Folgeerkrankungen. Ferner untersuchen wir die Regulation dieser Kinase.
Förderung:
DFG
Unsere Publikationen zu diesem Projekt:
Börchers S, Babaei R, Klimpel C, Duque Escobar J, Schröder S, Blume R, Malik MNH, Oetjen E (2017) TNFalpha-induced DLK activation contributes to apoptosis in the beta-cell line HIT. Naunyn-Schmiedeberg's Arch Pharmacol, 390: 813-825
Oetjen E (2016) Regulation of Beta-Cell function and mass by the dual leucine zipper kinase. Arch Pharm (Weinheim), 349: 410-413. doi: 10.1002/ardp.201600053. Review
Oetjen E, Lemcke T (2016) Dual leucine zipper kinase (MAP3K12) modulators: a patent review (2010-2015). Expert Opin Ther Pat, 25: 607-616
Wallbach M, Duque Escobar J, Babaeikelishomi R, Stahnke M-J, Blume R, Schröder S, Kruegel J, Maedler K, Kluth O, Kehlenbach RH, Miosge N, Oetjen E (2016) Distinct functions of the dual leucine zipper kinase depending on its subcellular function. Cell Signal, 28: 272- 283
Stahnke M-J, Dickel C, Schröder S, Kaiser D, Blume R, Stein R, Pouponnot C, Oetjen E (2014) Inhibition of human insulin gene transcription and MafA transcriptional activity by the dual leucine zipper kinase. Cell Signal, 26: 1792-1799
Phu DT, Wallbach M, Depatie C, Fu A, Screaton RA, Oetjen E (2011) Regulation of the CREB coactivator TORC by the dual leucine zipper kinase at different levels. Cell Signal, 23: 344-353
Plaumann S, Blume R, Börchers S, Steinfelder HJ, Knepel W, Oetjen E (2008) Activation of the dual-leucine-zipper bearing kinase (DLK) and induction of beta-cell apoptosis by the immunosuppressive drug cyclosporin A. Mol Pharmacol 73: 652-659
Oetjen E, Lechleiter A, Blume R, Nihalani D, Holzman L, Knepel W (2006) Inhibition of membrane depolarisation-induced CREB activity by the dual-leucine-zipper-bearing kinase in a pancreatic islet cell line. Diabetologia 49: 332-342
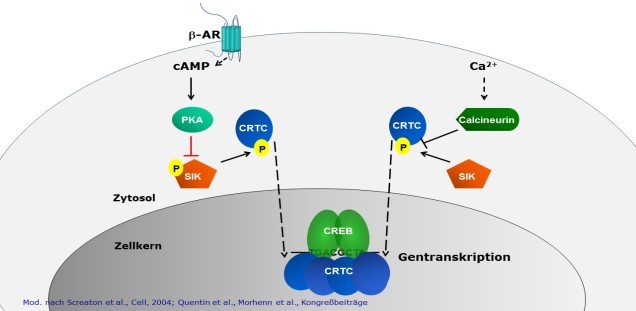
Kardiovaskuläres System und CRCT1
Prof. Dr. med. Elke Oetjen
Forschung
Rolle des transkriptionellen Koaktivators CRTC1 für die Entwicklung maladaptiver Herzhypertrophie.
Die maladaptive Herzhypertrophie führt zu einer Herzinsuffizienz, die einen der häufigsten Gründe für eine Krankenhauseinweisung darstellt. Das Enstehen dieser Herzhypertrophie ist noch nicht vollkommen verstanden. Unsere eigenen Ergebnisse zeigen, dass cyclic AMP regulated transcriptional co-activator 1 (CRTC1) in Kardiomyozyten durch beta-adrenerge Signale reguliert wird. In humanen und murinen Herzen mit HCM findet sich ein erhöhter Gehalt an CRTC1. Wir untersuchen deshalb die Rolle von CRTC1 für die Entwicklung der kardialen Hypertrophie.
Förderung:
DZHK
Werner-Otto-Stiftung
Unsere Publikationen zu diesem Projekt:
Morhenn K., Quentin T., Wichmann H., Steinmetz M., Prondzynski M., Söhren K.-D., Christ T., Geertz B., Schröder S., Schöndube F.A., Hasenfuss G., Schlossarek S., Zimmermann W.H., Carrier L., Eschenhagen T., Cardinaux J.-R., Lutz S., Oetjen E. (2019) Mechanistic role of CREB regulated transcription coactivator 1 in cardiac hypertrophy. J Mol Cell Cardiol, 127:31-43; doi: 10.1016/j.yjmcc.2018.12.001