

Unsere Arbeitsgruppen stellen sich vor
- AG Prof. Dr. Sabine Riethdorf | Mikrometastasierung
- Kontakt
-
AG Prof. Dr. Sabine Riethdorf | Mikrometastasierung
 Immunzytologie
ImmunzytologieMikrometastasierung
Die Aufklärung von Mechanismen, die an der frühen Disseminierung einzelner potenziell Metastasen-initiierender Zellen aus dem Tumorgewebeverband beteiligt sind, ist Ziel der Forschungsaktivitäten der Arbeitsgruppe.
Um disseminierte Tumorzellen (DTC) im Knochenmark und in Lymphknoten sowie zirkulierende Tumorzellen (CTC) im Blut von Patientinnen und Patienten mit hauptsächlich urologischen, gynäkologischen Tumoren sowie Tumoren aus dem Kopf-, Halsbereich und Glioblastomen zu detektieren und zu charakterisieren, setzen wir optimierte hochauflösende immunzytochemische und molekulare Verfahren ein. Im Mittelpunkt stehen dabei Analysen von potenziellen therapeutischen Zielstrukturen in DTC, CTC und in experimentellen Modellsystemen als Ausgangspunkt für die Testung und Entwicklung neuer zielgerichteter individueller Behandlungsstrategien.
Die Arbeitsgruppe ist mit translationalen Forschungsprojekten zur Analyse von CTC, die zum einen die prognostische Bedeutung dieser Zellen erhärten und zum anderen einen möglichen Einsatz der CTC-Analysen als Biomarker zur Stratifizierung der Patienten für gezielte Therapien untersuchen sollen, an einer Vielzahl von klinischen Studien beteiligt. In diesem Kontext ist die Arbeitsgruppe auch eines der Referenzzentren für die Beurteilung von CTC in den Mammakarzinomstudien DETECT III-V und TREAT-CTC (suchen Sie hier nach der Studiennummer "90091"), in denen der CTC-Nachweis bereits eine wichtige Entscheidungsgrundlage für die Behandlung der Patientinnen bildet.
-
-
KontaktProf. Dr. rer. nat.Sabine Riethdorf
- Forschungsgruppenleiterin
Standort
Campus Forschung N27 , 4. Etage, Raumnummer 04.007
- AG Prof. Dr. Harriet Wikman | Metastasierungs-assoziierte Gene
- Kontakt
-
AG Prof. Dr. Harriet Wikman | Metastasierungs-assoziierte Gene
 AG Wikman: Mitarbeiterinnen und Mitarbeiter
AG Wikman: Mitarbeiterinnen und MitarbeiterIdentifizierung und funktionelle Charakterisierung von metastasierungs-assoziierten Genen bei Brust- und Lungenkrebs
Unsere Arbeitsgruppe verfolgt das Ziel, die biologischen Prozesse einzelner Schritte der metastatischen Kaskade besser zu verstehen. Hierbei untersuchen wir insbesondere Gene und deren korrespondierende Genprodukte, die entweder mit einer frühen hämatogenen Disseminierung oder mit der Bildung von Hirnmetastasen assoziiert sind. Unsere Forschung fokussiert sich dabei auf Tumore, die aus Brust-, Lungen- oder Prostatagewebe entstehen.
Durch die Kombination unterschiedlicher analytischer Verfahren konnten wir einzelne Gene und Signalwege identifizieren, die mit einer frühen Disseminierung von Brust und Lungentumoren in Verbindung stehen (Wrage et al., Clin Cancer Res 2009 and Int J Cancer 2015; Werner, Cancer Discovery 2015). Momentan konzentrieren sich unsere Forschungsarbeiten auf die funktionelle Charakterisierung des RAI2- und HERC5-Proteins, die mit einer frühen Disseminierung ins Knochenmark sowie mit der Bildung von Hirnmetastasen in Verbindung stehen. Darüber hinaus führen wir Forschungsarbeiten zur Charakterisierung und klinischen Relevanz zirkulierender Tumorzellen (CTCs) durch (Hanssen et al., Scientific reports 2016).
Grundlage der Studien sind dabei sowohl Patientenmaterial als auch Zellkultur-basierende Modellsysteme. Für unsere Forschung nutzen wir die Kombination unterschiedlicher molekulargenetischer, biochemischer und zellbiologischer Arbeitsmethoden (z. B. shRNA-vermittelte RNA-Interferenz) sowie die Möglichkeiten funktioneller genomweiter Analysen.
-
-
Kontakt
 Prof. Dr.Harriet Wikman-Kocher
Prof. Dr.Harriet Wikman-Kocher- Forschungsgruppenleiterin
Standort
Campus Forschung N27 , 4. Etage, Raumnummer 04.006
- AG PD. Dr. Simon Joosse | Einzellzell-Genetik und Therapieantwort
- Kontakt
-
AG PD. Dr. Simon Joosse | Einzellzell-Genetik und Therapieantwort
 Group of Simon Joosse
Group of Simon JoosseLiquid biopsy guided therapy
The laboratory of Dr. Joosse focuses on using tumor markers in the blood of patients with breast and gynecological cancer to improve diagnostics, prognostics, and the prediction of therapy response.
We are investigating circulating tumor cells (CTCs) and cell-free, circulating tumor DNA (ctDNA) extracted from the blood for aberrations using advanced techniques such as Third and Next Generation Sequencing (long read sequencing). By identifying and characterizing these so called Circulating Tumor Cells (CTCs) we might be able to determine the metastatic potential of these cells, which might ultimately lead to improved treatment options for cancer patients.
We are a group consisting of 10-13 medical scientists, clincal scientists, PhD students, technicians, medical students, and MSc BSc students.
If you are interested in an internship or performing your PhD or MD in our laboratory, please feel free to send me your English CV and motivation letter by e-mail. -
-
Kontakt
 Priv.-Doz. Dr.Simon A. JoossePh.D.
Priv.-Doz. Dr.Simon A. JoossePh.D.- Forschungsgruppenleiter
- Wissenschaftlicher Arbeitsgruppenleiter
Standort
Campus Forschung N27 , 4. Etage, Raumnummer 04.005
- AG PD Dr. Katharina Harms-Effenberger |
- Kontakt
-
AG PD Dr. Katharina Harms-Effenberger |
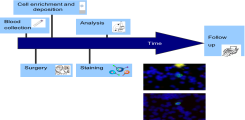 Project overview
Project overview
Liquid Biopsy Analytik in gynäkologischen Tumoren und Präneoplasien: Vulvakarzinom und VIN-Läsionen, Zervixkarzinom und CIN-Läsionen
In Kooperation mit der Klinik und Poliklinik für Gynäkologie des UKE sowie externen klinischen Partnern arbeitet unsere Arbeitsgruppe an Nachweisverfahren in der Liquid Biopsy (Flüssigbiopsie aus dem Blut anstelle der Gewebebiopsie) von Tumorarten, für die dieses Feld bislang wenig erforscht ist.
Im Fokus stehen hier zurzeit das Vulvakarzinom sowie das Zervixkarzinom. Des Weiteren betrachten wir auch bereits die Vorläuferläsionen – vulväre sowie zervikale intraepitheliale Neoplasien hohen Grades, deren Vorhandensein zur Tumorentstehung führen kann.
Mit neuesten technologischen Methoden isolieren wir beispielsweise CTCs (circulating tumor cells - zirkulierende Tumorzellen im peripheren Blut) und entwickeln neue Ansätze zur Charakterisierung der Zellen auf Proteinebene sowie genetischer und epigenetischer Ebene. Ziele, die wir mit der Liquid Biopsy-Analytik verfolgen sind vornehmlich: i) die Entwicklung von Panels (Markerkombinationen, bestimmte individuelle „Muster“), die den Patientinnen eine verbesserte Risikoabschätzung mit reduziertem Vor-, bzw. Nachsorgeaufwand geben können, und ii) die Erkennung möglicher therapeutischer Targets, die in der zukünftigen Behandlung zum Tragen kommen könnten.
Vakante Stellen:
Sollten Sie Interesse an einer medizinischen Doktorarbeit haben, melden Sie sich gern unter [email protected]. Wir freuen uns.
Zurück zur Übersicht
-
-
Kontakt
 Priv.-Doz. Dr. rer. nat.Katharina Harms-Effenberger
Priv.-Doz. Dr. rer. nat.Katharina Harms-Effenberger- Forschungsgruppenleiterin
Standort
Campus Forschung N27 , 4. Etage, Raumnummer 04.006
- AG Dr. Stefan Werner | Zellkernorganisation und phänotypische Plastizität
- Kontakt
-
AG Dr. Stefan Werner | Zellkernorganisation und phänotypische Plastizität
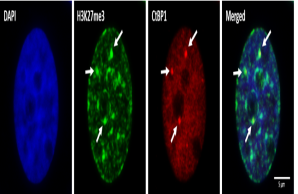 Prostatakrebszellen
ProstatakrebszellenZellkernorganisation und phänotypische Plastizität
Prostatakrebs ist in Deutschland bei Männern die häufigste Krebserkrankung. Metastasierter Prostatatkrebs ist eine lebensbedrohliche Erkrankung, die oft mit Medikamenten behandelt wird, die die Aktivität des Androgenrezeptors inhibieren. Trotz dieser Behandlung kommt es bei einigen Patienten zu einem Fortschreiten der Erkrankung und zur Ausbildung des sogenannten Kastrations-resistenten Prostatakarzinoms, welches resistent gegenüber diesen Therapieformen ist. Daher ist sowohl die die Erforschung von Resistenzmechanismen als auch die Erforschung von Methoden zur frühzeitigen Erkennung von betroffenen Patienten von großer klinischer Relevanz. Die Forschung in unserer Arbeitsgruppe konzentriert sich auf die Analyse molekularer Mechanismen, die die phänotypische Plastizität und intratumorale Heterogenität von Prostatakrebs beeinflussen. Eine zentrale Forschungsfrage ist, wie eine Deregulierung der chromosomalen Organisation bzw. die Verpackung der genetischen Information sich auf die Integrität des Genoms und die Differenzierung der Krebszellen auswirkt. Darüber hinaus arbeiten wir an der Verbesserung von Methoden zum Nachweis und zur Anreicherung zirkulierender Tumorzellen aus Blutproben von Prostatakrebspatienten. Gemeinsam mit unseren klinischen Partnern möchten wir unsere Erkenntnisse in die Klinik übertragen, um die Diagnose und Behandlung von Prostatakrebs zu verbessern.
-
-
Kontakt
 Priv.-Doz. Dr. rer. nat.Stefan Werner
Priv.-Doz. Dr. rer. nat.Stefan Werner- Forschungsgruppenleiter
Standort
Campus Forschung N27 , 4. Etage, Raumnummer 04.006
- AG Kai Bartkowiak | Zellstress und Disseminierung
- Kontakt
-
AG Kai Bartkowiak | Zellstress und Disseminierung
 Hypoxische Stressreaktion in Brustkrebszellen
Hypoxische Stressreaktion in BrustkrebszellenZellstress und Disseminierung
Tumorzellen sind häufig lebensfeindlichen Mikroumgebungsbedingungen oder schnellen Änderungen ihrer Mikroumgebung ausgesetzt. Geringer Sauerstoffpartialdruck (Hypoxie) oder geringe Glucosespiegel (Hypoglykämie) können Tumorzellen unter Zellstress setzen. Ähnlich können schnelle Änderungen in der Mikroumgebung wirken, wenn Tumorzellen aus ihrer gewohnten Mikroumgebung im Primärtumor in neue Mikroumgebungen von Sekundärorganen disseminieren. In beiden Fällen können Tumorzellen Zellstress erfahren, der durch die Aktivierung spezieller Schutz- oder Abwehrprogramme abgefangen werden kann.
Wir interessieren uns für Stressanpassungen, die bei der Disseminierung von Brustkrebszellen ins Knochenmark auftreten. Bei der Disseminierung von Primärtumorzellen in die Blutbahn und Ansiedlung der disseminierten Tumorzellen im Knochenmark sind die Tumorzellen sehr schnellen Änderungen ihrer Mikroumgebungen ausgesetzt. Zudem weist die hämatopoetische Stammzellnische eine sehr geringe Sauerstoffkonzentration auf. Tumorzellen, die sich an diesem Ort ansiedeln, können daher hypoxischem Stress ausgesetzt sein.
Da Stressanpassungen eine Antwort auf unphysiologische Mikroumgebungsbedingungen sind, kommen sie in normalen Körperzellen nur selten vor. Daher sind Proteine, die bei der Aktivierung von Zellbeschützenden Programmen wie der Antwort auf ungefaltete Proteine (engl. "unfolded protein response") aktiviert werden, gute Markerproteine für den Nachweis von Tumorzellen. In einem Nebeneffekt für eine erhöhte Toleranz gegenüber Mikroumgebungsstress können Tumorzellen auch eine erhöhte Toleranz gegen Therapien erwerben. Umgekehrt kann eine Identifizierung von verwundbaren Stellen in diesen Stressanpassungsprogrammen auch als Zielstrukturen für eine therapeutische Intervention offen legen. Somit können neue Erkenntnisse zu Stressantworten Mittel für einen spezifischen Nachweis von besonders widerstandsfähigen Tumorzellen und deren Beseitigung bereitstellen.
-
-
KontaktDr. rer. nat.Kai Bartkowiak
- Forschungsgruppenleiter
Standort
Campus Forschung N27 , 4. Etage, Raumnummer 04.027
- AG Dr. Volker Aßmann | Identifizierung Tumor-assoziierter Gene
- Kontakt
-
AG Dr. Volker Aßmann | Identifizierung Tumor-assoziierter Gene
Identifizierung, strukturelle und funktionelle Charakterisierung von Tumor-assoziierten Genen
Die Arbeitsgruppe beschäftigt sich mit der Identifizierung, strukturellen und funktionellen Charakterisierung von Genen, die möglicherweise eine wichtige Rolle bei der Entstehung und Progression des humanen Mammakarzinoms spielen könnten. Mit Hilfe eines von der Arbeitsgruppe entwickelten und erfolgreich durchgeführten genetischen "Screenings", einer sog. "Retrovirus-vermittelten cDNA-Expressionsklonierung von Protoonkogenen", konnten einige weitestgehend unbekannte Kandidatengene identifiziert werden, die den Schwerpunkt der Untersuchungen bilden.
Durch den Einsatz eines weitreichenden Spektrums molekularbiologischer, biochemischer, zellbiologischer und immunologischer Arbeitstechniken wird derzeit die Bedeutung einiger dieser Kandidatengene für das Mammakarzinom untersucht. Es ist zu hoffen, dass durch die Kombination eher deskriptiver Untersuchungen zur Expression der Kandidatengene in Primärtumoren und Metastasen mit Hilfe eigens von uns entwickelter Antikörper mit detaillierten Funktionsanalysen ein besseres Verständnis der molekularen Veränderungen, die zur Entstehung und Progression des Mammakarzinoms führen, erzielt werden kann.
-
KontaktDr. rer. nat.Volker Aßmann
- Sicherheitsbeauftragter Labor
Standort
Campus Forschung N27 , 4. Etage, Raumnummer 04.007