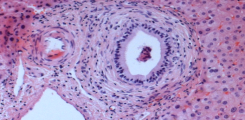
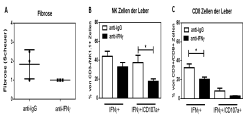Im Rahmen der Klinischen Forschergruppe 306 (KFO306) fördert die Deutsche Forschungsgemeinschaft die I. Medizinische Klinik des UKE bei der Erforschung der Primären Sklerosierenden Cholangitis (PSC).
Die PSC ist eine chronische, vernarbende Erkrankung der Gallengänge in und außerhalb der Leber. Die PSC ist in 2/3 der Fälle mit einer chronisch entzündlichen Darmerkrankung assoziiert. Die Erkrankung befällt vorwiegend junge Erwachsene und führt innerhalb von 10-20 Jahren zur biliären Leberzirrhose, Lebertransplantation oder zum Tod der Patienten durch die Entwicklung hepatobiliärer Malignome. Die Pathogenese der PSC ist unverstanden. Die PSC ist eine der häufigsten Indikationen zur Lebertransplantation, die derzeit die einzige wirksame Therapie dieser progredienten Erkrankung ist.
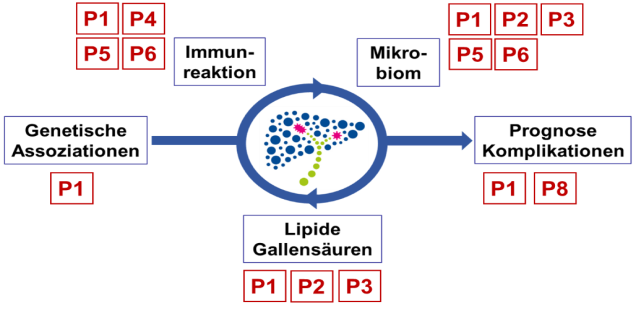
Unsere Klinische Forschergruppe setzt sich zum Ziel, die Pathogenese der PSC aufzuklären, um durch dieses Verständnis neue Therapiemöglichkeiten zu eröffnen. Wir postulieren, dass die Gallengangsentzündung durch eine fehlgeleitete Immunreaktion an der mucosalen Barriere verursacht wird. Wir vertreten die Hypothese, dass das Mikrobiom in der immunologischen und metabolischen Wechselwirkung mit dem Wirt hierbei eine große Rolle spielt. Um diese Interaktionen zu verstehen, werden Wissenschaftler verschiedener Expertise aus Grundlagen- und klinischer Forschung in der KFO306 zusammengeführt. Die Ziele der KFO306 sind die Aufklärung der Immunpathogenese der PSC mit einem Fokus auf das intestinale und biliäre Mikrobiom und die Immunreaktion an der mucosalen Barriere, die Identifikation der pathogenetischen Zusammenhänge zwischen Mikrobiom und dem Gallensäure- und Lipidstoffwechsel sowie der Entzündung in Leber und Colon. Das Ziel ist es, diese Erkenntnisse in in klinische Studien zu übertragen.
Hierzu wurden insgesamt sieben Projektgruppen gebildet:
-
Projekt 1: Charakterisierung des intestinalen und biliären Mikrobioms von Patienen mit Primär Sklerosierender Cholangitis (PSC)
Projekt 1
Charakterisierung des intestinalen und biliären Mikrobioms von Patienten mit Primär Sklerosierender Cholangitis (PSC)
In den letzten Jahren wurde deutlich, dass unsere Gesundheit maßgeblich durch die Interaktion mit den uns kolonisierenden Bakterien, Viren, Pilzen und Archaebakterien (die Summe wird als „Mikrobiom“ bezeichnet) geprägt wird. Insbesondere das intestinale Mikrobiom scheint hier durch die Menge der Keime und die enge räumliche Interaktion mit dem mucosalen Immunsystem eine wichtige Rolle einzunehmen. Über das biliäre Mikrobiom hingegen ist bisher sehr wenig bekannt. Da aber, entgegen früherer Annahmen, die Galle gerade bei PSC Patienten nicht steril ist, kommt dem biliären Mikrobiom, das in diesem Projekt untersucht werden soll, vermutlich eine wichtige pathogenetische Bedeutung zu.
In diesem Projekt soll die Charakterisierung des intestinalen und biliären Mikrobioms, sowie der Zusammenhang zwischen Genetik, Metabolismus und Ernährung mit dem Mikrobiom untersucht werden. Gezielt soll der Einfluss der Befunde auf die T-Zelldifferenzierung und den Verlauf der Erkrankung analysiert werden. Über das Verständnis dieser Zusammenhänge sollen neue Therapiemöglichkeiten (z.B. über Ernährungsintervention) für eine Erkrankung eröffnet werden, für die es bisher keine wirksame Therapie gibt.
Projektleitung
 Prof. Dr. med.Christoph Schramm
Prof. Dr. med.Christoph Schramm- Senior physician
- Endowed professorship of the Helmut & Hannelore Greve foundation
- Medical Specialist in Internal Medicine and Gastroenterology
Location
Main Building O10 , 2nd FloorProf. Dr. rer. nat.
Andre Franke
Direktor, Institut für Klinische Molekularbiologie (IKMB), Christian-Albrechts-Universität zu Kiel (CAU), Universitätsklinikum Schleswig Holstein • Campus Kiel, Schittenhelmstr. 12, 24105 Kiel
Wissenschaftliche Mitarbeiter
AG Schramm
AG Franke
Aktuelle projektbezogene Publikationen
Wang J*, Thingholm L*, Sventoraityte J*, …, Heinsen FA, Rühlemann MC, …, Franke A. Genome-wide association analysis identifies variation in vitamin D receptor and other host factors influencing the gut microbiota. Nat Genet. Accepted.
Rühlemann MC, Heinsen FA, Zenouzi R, Lieb W, Franke A, Schramm C. Faecal microbiota profiles as diagnostic biomarkers in primary sclerosing cholangitis. Gut 2016 May 23. pii: gutjnl-2016-312180. doi: 10.1136/gutjnl-2016-312180. [Epub ahead of print] No abstract available.
Wang J, Kalyan S, Steck N, Turner LM, Harr B, Künzel S, Vallier M, Häsler R, Franke A, Oberg HH, Ibrahim SM, Grassl GA, Kabelitz D, Baines JF. Analysis of intestinal microbiota in hybrid house mice reveals evolutionary divergence in a vertebrate hologenome. Nat Commun 2015 Mar 4;6:6440. doi: 10.1038/ncomms7440. PMID: 25737238
Ehlken H, Lohse AW, Schramm C. Transient elastography in primary sclerosing cholangitis-the value as a prognostic factor and limitations. Gastroenterology 2014;147:542-3.
Zenouzi R, Weismüller TJ, Hübener P, Schulze K, Bubenheim M, Pannicke N, Weiler-Normann C, Lenzen H, Manns MP, Lohse AW, Schramm C. Low Risk of Hepatocellular Carcinoma in Patients with Primary Sclerosing Cholangitis with Cirrhosis. Clin Gastroenterol Hepatol 2014;12:1733-8.
Sebode* M, Peiseler* M, Franke A, …, Schramm C. Reduced FOXP3+ regulatory T cells in patients with primary sclerosing cholangitis are associated with IL-2RA gene polymorphisms. J Hepatol 2014;60:1010-6
-
Projekt 2: Analyse des pathogenetischen Zusammenhangs von chronisch entzündlichen Darmerkrankungen mit einer Primär Sklerosierenden Cholangitis
Projekt 2
Analyse des pathogenetischen Zusammenhangs von chronisch-entzündlichen Darmerkrankungen mit einer Primär Sklerosierenden Cholangitis
PSC Patienten in nordeuropäischen Ländern entwickeln mit einer Prävalenz von 60% - 80% ebenfalls eine chronisch-entzündliche Darmerkrankung (CED), insbesondere eine Colitis Ulcerosa (UC) ähnliche Erkrankung, und weisen darüber hinaus ein erhöhtes Risiko für die Entwicklung von Darmkrebs auf. Die Ursachen für diese Assoziation sind derzeit unzureichend verstanden.
Es gibt mehrere Hypothesen, die den Zusammenhang einer CED und PSC erklären könnten. Erstens könnten beiden Erkrankungen gemeinsame genetische Prädispositionen zugrunde liegen. Zweitens könnte eine CED die Entwicklung einer PSC begünstigen. Drittens könnte eine PSC die Entwicklung einer CED begünstigen. Das Ziel dieses Projekts ist es diese Hypothesen zu testen, wobei wir entgegen der Standardmeinung die dritte Hypothese favorisieren.
Des Weiteren glauben wir, dass ein Schlüssel zum besseren Verständnis der Assoziation von CED und PSC die Charakterisierung von Interaktionen des intestinalen Mikrobioms mit dem Gallensäuremetabolismus und der daraus resultierenden Aktivierung des intestinalen Immunsystems ist. Wir stellen die Hypothese auf, dass Interaktionen zwischen Gallensäuren in PSC-Patienten und ihrem intestinalen Mikrobiom die Suszeptibilität für die Entwicklung chronisch entzündlicher Darmerkrankungen und kolorektaler Karzinome fördern.
Projektleitung
 Prof. Dr. med.Samuel Huber
Prof. Dr. med.Samuel Huber- Director of the department
- Head of Molecular Gastroenterology and Immunology
- Medical Specialist in Internal Medicine and Gastroenterology
Location
Main Building O10 , 2nd Floor Location
Location
Campus Forschung N27 , 4th Floor, Room number 04.036Wissenschaftliche Mitarbeiter
Simon Bohmann, Doktorand
Aktuelle projektbezogene Publikationen
Gagliani N, Vesely MC, Iseppon A, Brockmann L, Xu H, Palm NW, de Zoete MR, Licona-Limon P, Paiva RS, Ching T, Weaver C, Zi X, Pan X, Fan R, Garmire LX, Cotton MJ, Drier Y, Bernstein B, Geginat J, Stockinger B, Esplugues E, Huber S*, Flavell RA*. TH17 cells transdifferentiate into regulatory T cells during resolution of inflammation. Nature 2015; Apr 29. doi: 10.1038/nature14452. [Epub ahead of print].
Carambia A, Freund B, Schwinge D, Bruns OT, Salmen SC, Ittrich H, Reimer R, Heine M, Huber S, Waurisch C, Eychmuller A, Wraith DC, Korn T, Nielsen P, Weller H, Schramm C, Luth S, Lohse AW, Heeren J, Herkel J. Nanoparticle-based autoantigen delivery to Treg-inducing liver sinusoidal endothelial cells enables control of autoimmunity in mice. J Hepatol 2015;62:1349-1356.
Bedke T*, Iannitti RG*, De Luca A, Giovannini G, Fallarino F, Berges C, Latge JP, Einsele H, Romani L, Topp MS. Distinct and complementary roles for Aspergillus fumigatus-specific Tr1 and Foxp3+ regulatory T cells in humans and mice. Immunol Cell Biol 2014;92:659-670.
Carambia A, Freund B, Schwinge D, Heine M, Laschtowitz A, Huber S, Wraith DC, Korn T, Schramm C, Lohse AW, Heeren J, Herkel J. TGF-beta-dependent induction of CD4(+)CD25(+)Foxp3(+) Tregs by liver sinusoidal endothelial cells. J Hepatol 2014;61:594-599.
-
Projekt 3: Bedeutung des Lipidstoffwechsels für die Pathogenese der Primär Sklerosierenden Cholangitis (PSC)
Projekt 3
Bedeutung des Lipidstoffwechsels für die Pathogenese der Primär Sklerosierenden Cholangitis (PSC)
Bei PSC-Patienten ist der Stoffwechsel von lipophilen Metaboliten insbesondere in der Leber und im Intestinaltrakt vermutlich aufgrund des gestörten Gallentransportes verändert, wobei die Relevanz dieser komplexen Änderungen für die Pathogenese der PSC-Erkrankung nicht verstanden ist. Neben ihren vielfältigen Funktionen für die Homöostase des Stoffwechsels wurde in den letzten Jahren deutlich, dass Lipide entzündliche Prozesse sowie die Entstehung und Progression chronischer metabolischer Erkrankungen wie Nicht-alkoholische Steatohepatitis (NASH), Atherosklerose und Diabetes mellitus maßgeblich beeinflussen. Lipid-abhängige Signalwege werden über verschiedene Mechanismen überwiegend von Derivaten der Fettsäuren, Phospholipiden und Cholesterin gesteuert. Gallensäuren sind ebenfalls Derivate des Cholesterins und sind an der PSC-Pathogenese über verschiedene Mechanismen beteiligt. Unter physiologischen Bedingungen werden in der adulten, humanen Leber pro Tag ca. 500 mg Cholesterin zu Gallensäuren umgewandelt.
Die im Rahmen einer PSC-Erkrankung vorliegende Störung des Gallensäurenfluxes führt somit - vermutlich in Abhängigkeit vom gastrointestinalen Mikrobiom - zu komplexen Änderungen im systemischen und zellulären Lipoprotein-, Cholesterin- und Gallensäurestoffwechsel. Diese Wechselwirkung beeinflusst dabei vermutlich nicht nur metabolische, sondern auch immunologische Reaktionen und damit die Entstehung und Progression der PSC. Erste Studien zur Charakterisierung metabolischer Signaturen deuten auf differentielle Lipidmuster im Serum von Patienten mit PBC und PSC hin. Die gleichzeitige Analyse von potentiell immun-aktiven Cholesterin- und Gallensäurenderivaten aus Galle, Faeces, Leber, Urin und Lipoproteinfraktionen in diesen Patientenkollektiven, sowie die Analyse der funktionellen Bedeutung dieser Veränderungen u.a. durch Diät- und Interventionsstudien in relevanten Tiermodellen sind bislang nicht durchgeführt worden und sind Gegenstand dieses Teilprojektes.
Projektleitung
 Prof. Dr. rer. nat. Dipl.-Biochem.Jörg Heeren
Prof. Dr. rer. nat. Dipl.-Biochem.Jörg Heeren- Heisenberg-Professorship for Immuno Metabolism
- Deputy director of the institute
Location
N30 Fritz Schumacher-Haus, 2nd Floor, Room number 204aWissenschaftliche Mitarbeiter
Dipl.-Lebensmittelchem.Clara JohnLocation
N30 Fritz Schumacher-Haus, 2nd FloorAktuelle projektbezogene Publikationen
Berbée JF, Boon MR, Khedoe PP, Bartelt A, Schlein C, Worthmann A, Kooijman S, Hoeke G, Mol IM, John C, Jung C, Vazirpanah N, Brouwers LP, Gordts PL, Esko JD, Hiemstra PS, Havekes LM, Scheja L, Heeren J*, Rensen PC*. Brown fat activation reduces hypercholesterolaemia and protects from atherosclerosis development. Nat Commun 2015;6:6356.
Hoffmann LS, Etzrodt J, Willkomm L, Sanyal A, Scheja L, Fischer AW, Stasch JP, Bloch W, Friebe A, Heeren J, Pfeifer A. Stimulation of soluble guanylyl cyclase protects against obesity by recruiting brown adipose tissue. Nat Commun 2015;6:7235.
Baumeier C, Kaiser D, Heeren J, Scheja L, John C, Weise C, Eravci M, Lagerpusch M, Schulze G, Joost HG, Schwenk RW, Schürmann A. Caloric restriction and intermittent fasting alter hepatic lipid droplet proteome and diacylglycerol species and prevent diabetes in NZO mice. Biochim Biophys Acta 2015;1851:566-76.
-
Projekt 4: Die Rolle von IFN-gamma in der Immunpathogenese der PSC
Projekt 4
Die Rolle von IFN-gamma in der Immunpathogenese der PSC
Die Expression verschiedener IFNγ-assozierter Cytokine und Chemokine ist bei PSC Patienten erhöht, ihre Rolle für die Pathogenese ist jedoch unklar. PSC Patienten zeigen sowohl erhöhte IFN-γ Werte im Serum, als auch vermehrt IFN-γ positive Lymphozyten im Lebergewebe.
Neutralisation von IFNγ reduziert Fibrose sowie NK- und CD8+ T-Zell-Antwort in Mdr2-/- Mäusen. Mdr2-/- Mäuse wurden mit Kontroll-IgG oder anti-IFNg Antikörper für 2 Wochen (2x pro Woche 0.5mg/Maus) behandelt. Der Grad der Fibrose wurde nach dem Scheuer System von einem Pathologen bestimmt (A). Nicht-parenchymale Zellen der Leber wurden mit PMA [50ng/ml] und Ionomycin [1µg/ml] stimuliert, mit Brefeldin A [10µg/ml] behandelt, für 6 Stunden inkubiert und durchflusszytometrisch analysiert (B,C).
Unsere Arbeitshypothese ist, dass IFNγ-produzierende Immunzellen eine wesentliche Rolle in der Pathogenese der PSC spielen und dass die Neutralisierung von IFNg oder Depletion der IFNg-produzierenden Lymphozyten eine Verbesserung des Krankheitsbildes zur Folge hat. Wir werden deshalb folgende Ziele verfolgen:
- Zur Charakterisierung der Immunantwort werden Frequenz, Phänotyp, Funktion und Aktivierungsgrad von Lymphozytenpopulationen peripherer mononukleärer Blutzellen (PBMCs) aus PSC Patienten bestimmt. Auf diesem Wege sollen die Zellen identifiziert werden, die IFNγ-produzieren oder aber durch IFNγ aktiviert werden. Die identifizierten Zellpopulationen sollen darauffolgend in leberinfiltrierenden Lymphozyten aus Explantat-Lebern von PSC Patienten bestätigt werden. Wir gehen davon aus, dass der von den Immunzellen verursachte Schaden auf deren Zytotoxizität zurückzuführen ist.
- Funktionelle Analysen sollen in vivo in unterschiedlichen Mausmodellen durchgeführt werden. In einem therapeutischen Ansatz sollen die Immunzellpopulationen, die IFNγ produzieren, bzw. durch IFNγ aktiviert werden, durch die Applikation von Antikörpern depletiert und die Effekte auf die Pathogenese der Cholangitis untersucht werden.
- Durch Charakterisierung der IFNγ-vermittelten Signaltransduktion wird es möglich abzuschätzen, ob beispielsweise bereits zugelassene MAPK Inhibitoren für die Therapie der PSC in Frage kämen.
- Zur weiteren Analyse der Funktion der Immunzellen und ihrer Lokalisation sollen Mausmodelle etabliert werden, die eine chronische Cholangitis aufweisen und gleichzeitig defizient für IFNg bzw. die entsprechenden IFNg-produzierenden Zellen sind.
Projektleitung
 Dr. rer. nat.Roja BarikbinLocation
Dr. rer. nat.Roja BarikbinLocation
Campus Forschung N27 , 1st Floor, Room number 01.006 Prof. Dr. rer. nat.Gisa Tiegs
Prof. Dr. rer. nat.Gisa Tiegs- Director of the institute
- Project leader
Location
Campus Forschung N27 , Ground Floor, Room number 00.103Wissenschaftliche Mitarbeiter
Gevitha Ravichandran
Aktuelle projektbezogene Publikationen
Schwinge D, Carambia A, Quaas A, Krech T, Wegscheid C, Tiegs G, Prinz I, Lohse AW, Herkel J, Schramm C. Testosterone suppresses hepatic inflammation by the downregulation of IL-17, CXCL-9, and CXCL-10 in a mouse model of experimental acute cholangitis. J Immunol 2015;194:2522-30.
Burghardt S, Claass B, Erhardt A, Karimi K, Tiegs G. Hepatocytes induce Foxp3+ regulatory T cells by Notch signaling. J Leukoc Biol 2014;96:571-577.
Burghardt S, Erhardt A, Claass B, Huber S, Adler G, Jacobs T, Chalaris A, Schmidt-Arras D, Rose-John S, Karimi K, Tiegs G. Hepatocytes contribute to immune regulation in the liver by activation of the Notch signaling pathway in T cells. J Immunol 2013;191:5574-5582.
Barikbin R, Neureiter D, Wirth J, Erhardt A, Schwinge D, Kluwe J, Schramm C, Tiegs G, Sass G. Induction of heme oxygenase 1 prevents progression of liver fibrosis in Mdr2 knockout mice. Hepatology 2012;55:553-562.
-
Projekt 5: Rolle dendritischer Zellen in der Pathogenese der PSC
Projekt 5
Die Rolle dendritischer Zellen in der Pathogenese der PSC
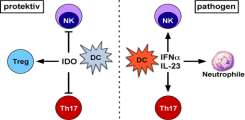
In diesem Projekt soll die Hypothese untersucht werden, dass dendritische Zellen (DCs) in der PSC Pathogenese eine wichtige Rolle spielen. Wir vermuten eine entscheidende krankheitsmodulierende Funktion durch Leber-DCs, da diese, aufgrund ihrer Positionierung in den Portalfeldern um die Gallengänge herum, eine wichtige Wächterfunktion übernehmen und Entzündungsreaktionen einleiten können.
Insbesondere in der frühen Entzündungsphase der PSC scheinen DCs eine wichtige Rolle zu spielen und auf mikrobielle Stimuli zu. Dabei kann sowohl eine erhöhte mikrobielle Translokation aus dem Darm über das Pfortaderblut, aber auch eine aberrante Keimbesiedlung der Gallengänge zu einer Aktivierung der Leber-DCs führen. Je nach Kontext können DCs dann Entzündung fördern oder hemmen, indem sie andere Zelltypen entsprechend beeinflussen, wobei verschiedene DC Subpopulationen unterschiedliche Funktionen ausüben.
Projektleitung
 Prof. Dr. rer. nat.Johannes Herkel
Prof. Dr. rer. nat.Johannes Herkel- Head of research group
Location
O58, 3rd Floor, Room number 306 Prof. Dr.Marcus Altfeld
Prof. Dr.Marcus Altfeld- Project leader
Location
HPI, 1st Floor, Room number N63 | 1105Wissenschaftliches Personal
AG Herkel
 Location
Location
O58, 3rd Floor, Room number 306aAktuelle projektbezogene Publikationen
Schwinge D, Carambia A, Quaas A, Krech T, Wegscheid C, Tiegs G, Prinz I, Lohse AW, Herkel J, Schramm C. Testosterone suppresses hepatic inflammation by the downregulation of IL-17, CXCL-9, and CXCL-10 in a mouse model of experimental acute cholangitis. J Immunol 2015; 194:2522-30.
Altfeld M, Gale M. Innate Immunity against HIV-1 infection. Nat Immunol 2015;16:554-562.
Sebode M, Peiseler M, Franke B, Schwinge D, Schoknecht T, Wortmann F, Quaas A, Petersen BS, Ellinghaus E, Baron U, Olek S, Wiegard C, Weiler-Normann C, Lohse AW, Herkel J, Schramm C. Reduced FOXP3(+) regulatory T cells in patients with primary sclerosing cholangitis are associated with IL2RA gene polymorphisms. J Hepatol 2014;60:1010-6.
Carambia A, Freund B, Schwinge D, Heine M, Laschtowitz A, Huber S, Wraith DC, Korn T, Schramm C, Lohse AW, Heeren J, Herkel J. TGF-β-dependent induction of CD4⁺CD25⁺Foxp3⁺ Tregs by liver sinusoidal endothelial cells. J Hepatol 2014;61:594-9.
-
Projekt 6: Die Rolle von NETs und extrazellulärer DNA in der Pathogenese der PSC
Projekt 6
Die Rolle von NETs und extrazellulärer DNA in der Pathogenese der PSC
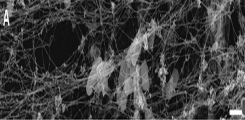
Neutrophil Extracellular Traps (NETs) bestehen aus DNA-Filamenten, die ein extrazelluläres, netzartiges Geflecht bilden. Neutrophile bilden NETs in Infektionen, um pathogene Bakterien einzufangen und abzutöten (Abb. 1).
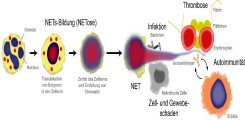
Die antimikrobielle Funktion von NETs basiert hierbei auf Histonen und Enzymen aus Granula, die an den extrazellulären DNA-Filamenten anheften. Die NET-Bildung (NETose) ist ein Prozess, in dem Kern-DNA dekondensiert wird und sich intrazelluläre Membranen auflösen (Abb. 2, links). Als Konsequenz vermischen sich DNA-Filamente und granuläre Proteine innerhalb der Zelle. Neutrophile sind anschließend in der Lage durch mehrere Mechanismen NETs aus der Zelle zu schleusen. Kontrolliert wird die NETose durch das Enzym Peptidylargininedeiminase 4 (PAD4). PAD4 ist eine von insgesamt 4 PADs im Menschen. PAD4 enthält ein Kernlokalisationssignal und wird selektiv in Neutrophilen exprimiert. In aktivierten Neutrophilen wandert PAD4 in den Zellkern, um Argininreste in Histonen zu Citrullin umzuwandeln. Als Konsequenz verringert sich die positive Ladung von Histonen, die Bindung von Histonen zu DNA wird geschwächt und die DNA entfaltet sich.
Die antimikrobielle Aktivität von NETs wurde zusammen mit deren Entdeckung vor ca. 10 Jahren beschrieben. In den letzten Jahren häufen sich die Anzeichen, dass NETs integraler Bestandteil der Pathogenese von entzündlichen Erkrankungen sind. Grund hierfür sind prothrombotische, zytotoxische und immunogene Eigenschaften von NETs, die vor allem durch Histone und Neutrophilen-Enzyme in NETs vermittelt werden (Abb. 2, rechts). Histone bilden mit 70% den Hauptanteil der Proteine in NETs. Sie verfügen neben ihrer Funktion in der Verpackung von DNA über bemerkenswerte zytotoxische Eigenschaften.
NETs können somit über die Bildung von Immunkomplexen zur Krankheitsentstehung beitragen. NETs wurden in einer Reihe autoimmuner Erkrankungen nachgewiesen. So zeigten histologische Untersuchungen von Nierenbiopsien die für NETs charakteristischen Komplexe aus extrazellulärer DNA, Histonen und MPO in Patienten mit Anti-Neutrophilen-zytoplasmatischen-Antikörper-(ANCA)-assoziierten Vaskulitiden. ANCA sind mit primär sklerosierender Cholangitis (PSC) assoziiert. Ob NETs in PSC gebildet werden und welche Funktion sie in der Pathogenese einnehmen, ist nicht erforscht. Es gibt allerdings Hinweise für eine zentrale Rolle von Neutrophilen in der PSC: Antikörper gegen Neutrophile können in bis zu 38% der PSC-Patienten im Serum und der Gallenflüssigkeit nachgewiesen werden.
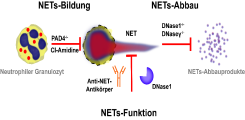
Wir haben 3 Strategien vorbereitet, um die Rolle von NETs in vivo zu untersuchen (Abb. 3). Sie basieren auf der Blockierung der NETs-Bildung, des NETs-Abbaus, sowie der NET-Funktionen.
Um die Bildung von NETs in vivo zu verhindern, verwenden wir Mäuse mit einem Defekt in dem Enzym PAD4, deren Neutrophile keine NETs bilden. Alternativ haben wir die Möglichkeit, die NETs-Bildung pharmakologisch durch die Injektion eines PAD-Inhibitors (Cl-Amidine) zu unterbinden.
Die zweite Strategie zielt darauf ab, den Abbau von NETs zu unterbinden, und die dritte Strategie dient dazu, die Funktion von gebildeten NETs zu neutralisieren. Dieser Ansatz dient als experimentelle Therapie gegen NETs und basiert auf der Injektion von Antikörpern oder DNase1.
Projektleitung
Dr. rer. nat.Tobias Fuchs- Principal investigator
Location
Campus Forschung N27 , 2nd Floor, Room number 02.092Wissenschaftlicher Mitarbeiter
Postdoktorandin/Postdoktorand n.n.
Aktuelle projektbezogene Publikationen
Jiménez-Alcázar M, Napirei M, Panda R, …, Fuchs TA. Impaired DNase1-mediated degradation of neutrophil extracellular traps is associated with acute thrombotic microangiopathies. J Thromb Haemost 2015;5:732-42.
Hartl J, Ehlken H, Weiler-Normann C, …, Schramm C. Patient selection based on treatment duration and liver biochemistry increases success rates after treatment withdrawal in autoimmune hepatitis. J Hepatol 2015;62:642-6.
Lohse AW, Weiler-Normann C. Not all PBC is the same! Gastroenterology 2013;144:494-7.
Weiler-Normann C, Schramm C, Quaas A,…, Lohse AW. Infliximab as a rescue treatment in difficult-to-treat autoimmune hepatitis. J Hepatol 2013;58:529-34.
-
Projekt 8: Einfluss der PSC auf das skelettale Remodeling
Projekt 8
Einfluss der PSC auf das skelettale Remodeling
Um eine Langzeitstabilität des Skeletts zu erreichen, unterliegt die Knochenmatrix einem ständigen Umbau, genannt Knochen-Remodeling. Dieser physiologisch relevante Prozess wird durch die koordinierte Aktivität zweier Zelltypen vermittelt, den Knochen-bildenden Osteoblasten und den Knochen-resorbierenden Osteoklasten. Eine Störung des zellulären Gleichgewichts zwischen diesen beiden Zelltypen bildet die Grundlage zahlreicher skelettaler Erkrankungen, wobei die Osteoporose die mit Abstand höchste Prävalenz aufweist.
Die Entwicklung einer Osteoporose gilt als prinzipielle Komplikation bei chronischen cholestatischen Lebererkrankungen, wobei sich die meisten publizierten Studien auf die primäre biliäre Zirrhose (PBC) beziehen. Obwohl die hier beschriebene Osteoporose-Prävalenz durchschnittlich im Bereich von 30 % lag, konnten die zugrundeliegenden Mechanismen jedoch noch nicht geklärt werden. Gleiches gilt für die PSC, die im Vergleich zur PBC eher in jüngeren Patienten auftritt, von denen mehr als 60 % chronisch entzündliche Darmerkrankungen (CED) im Sinne einer PSC-assoziierten Colitis aufweisen. Zwar konnte in einer umfassenden Studie durch jährliche Messung des Knochenmineralgehalts nachgewiesen werden, dass 15 % der insgesamt 273 untersuchten Patienten mit PSC eine Osteoporose entwickeln, allerdings wurden hierbei nicht alle Parameter des Knochen-Remodelings evaluiert.
Abb.: Osteologische Untersuchung eines 46-jährigen Patienten mit PSC.
(A) Die Ermittlung des Knochenmineralgehalts mittels DXA ergab einen T-Wert von – 2,6 und somit die Diagnose einer Osteoporose. Die rechts eingezeichneten Linien geben Mittelwert + Standardweichung in der Skelett-gesunden Bevölkerung an.
(B) Durch HR-pQCT Messung an der Tibia zeigte sich, dass nur die Trabekel-Anzahl (Tb.N, trabecular number) im Referenzbereich lag, während das trabekuläre Knochenvolumen (BV/TV, bone volume per tissue volume), die trabekuläre Knochendichte (Tb.Th. trabecular thickness) und die kortikale Dicke (C.Th., cortical thickness) deutlich reduziert waren.
Neben der inflammatorischen Komponente der PSC-assoziierten Osteoporose, deren Relevanz im vorliegenden Projekt untersucht werden soll, gibt es weitere Erklärungsansätze für den Einfluss einer PSC auf das Knochen-Remodeling. So konnte in vitro gezeigt werden, dass Bilirubin, dessen Serum-Konzentration im Verlauf der PSC ansteigt, einen negativen Einfluss auf die Proliferation humaner Osteoblasten vermittelt. Zudem wurde oftmals diskutiert, dass eine Störung der Vitamin-D-Synthese einen negativen Einfluss auf die Knochenmineralisation vermitteln könnte, was jedoch in einigen klinischen Studien zu chronisch cholestatischen Lebererkrankungen nicht bestätigt werden konnte.
Ziel dieses Projekts ist es, die vorhandene Infrastruktur am Institut für Osteologie und Biomechanik zu nutzen, um die bei PSC-Patienten auftretende Osteopathie auf zellulärer und molekularer Ebene zu verstehen. Hierbei ist es entscheidend, dass die klinische Relevanz der erzielten Daten nur in Kombination mit den Erkenntnissen aus anderen Teilprojekten der Forschergruppe validiert werden kann, da es von zentraler Bedeutung sein wird, den Knochen-Status mit anderen klinischen Parametern zu korrelieren. Unsere Hypothese ist, dass die mit PSC assoziierten skelettalen Pathologien primär auf einer Hemmung der kortikalen Knochenbildung beruhen, welche durch bestimmte Zytokine (z.B. IL17, IL22) vermittelt sein könnte. Zusätzlich zu unserem Hypothesen-orientierten Ansatz verfolgen wir allerdings auch eine ergebnisoffene Strategie, mit der auch weitere Erklärungsmöglichkeiten (z.B. ein Einfluss von Gallensäuren, eine Aktivierung der Osteoklasten oder eine Störung der Mineral-Homöostase) überprüft werden sollen. Vor dem Hintergrund, dass es bislang keine zellulären oder molekularen Erkenntnisse gibt, welche die hohe Prävalenz der Osteoporose bei PSC-Patienten erklären, ist es zudem wahrscheinlich, dass die Planung des Projekts im Verlauf noch Ergebnis-abhängig modifiziert wird.
Projektleitung
 Prof. Dr. med.Michael AmlingMBA
Prof. Dr. med.Michael AmlingMBA- Director of the institute
- Medical Specialist in Orthopaedics and Traumatology
Location
Lottestraße 59, 22529 Hamburg, 1st Floor Prof. Dr. rer. nat.Thorsten Schinke
Prof. Dr. rer. nat.Thorsten Schinke- Deputy director of the institute
Location
Campus Forschung N27 , 1st FloorWissenschaftliche Mitarbeiter
 Prof. Dr. med.Florian BarvencikMBA
Prof. Dr. med.Florian BarvencikMBA- Executive senior physician
- Medical Specialist in Orthopaedics and Traumatology
Location
Lottestraße 59, 22529 Hamburg, 1st FloorDr. med.Tobias Schmidt- Assistant physician
- Assistant Physician
Aktuelle projektbezogene Publikationen
Jeschke A, Catala-Lehnen P, Sieber S, Bickert T, Schweizer M, Koehne T, Wintges K, Marshall RP, Mautner A, Duchstein L, Otto B, Horst AK, Amling M, Kreienkamp HJ, Schinke T. Sharpin Controls Osteogenic Differentiation of Mesenchymal Bone Marrow Cells. J Immunol. 2015;195:3675-84.
Krause M, Keller J, Beil B, van Driel I, Zustin J, Barvencik F, Schinke T, Amling M. Calcium gluconate supplementation is effective to balance calcium homeostasis in patients with gastrectomy. Osteoporos Int 2015;26:987-995.
Keller T, Catala-Lehnen P, Huebner AK, Jeschke A, Lueth A, Krause M, Koehne T, Albers J, Schulze J, Schilling S, Haberland M, Denninger H, Heckt T, Neven M, Hermans-Borgmeyer I, Streichert T, Breer S, Barvencik F, Levkau B, Rathkolb B, Wolf E, Calzada-Wack J, Neff F, Gailus-Durner V, Fuchs H, Hrabe de Angelis M, Klutmann S, Tsourdi E, Hofbauer LC, Kleuser B, Chun J, Schinke T, Amling M. Calcitonin controls bone formation by inhibiting the release of sphingosine 1-phosphate from osteoclasts. Nat Comm 2014;5:5215.
Barvencik F, Kurth I, Koehne T, Stauber T, Zustin J, Tsiakas K, Ludwig CF, Beil FT, Pestka JM, Hahn M, Santer R, Supanchart C, Kornak U, Del Fattore A, Jentsch TJ, Teti A, Schulz A, Schinke T, Amling M. CLCN7 and TCIRG1 mutations differentially affect bone matrix mineralization in osteopetrotic individuals. J Bone Miner Res 2014;29:982-991.
Keller J, Schinke T. The role of the gastrointestinal tract in calcium homeostasis and bone remodeling. Osteoporos Int 2013;24:2737-2748.
Die KFO306 strukturiert und fördert darüber hinaus die Rekrutierung und Ausbildung von Nachwuchswissenschaftlern im Rahmen des Clinician Scientist Programms.
Leitung
Sprecher der KFO 306

- Director of the department
- Medical Specialist in Internal Medicine and Gastroenterology
Leiter der Klinischen Forschergruppe

- Senior physician
- Endowed professorship of the Helmut & Hannelore Greve foundation
- Medical Specialist in Internal Medicine and Gastroenterology
Mercator-Fellow
Prof. Dr. Olivier Chazouilleres
Hôpital Saint-Antoine, Département Métabolisme-Inflammation, Paris
Mitarbeiter
Wissenschaftliche Mitarbeiter im Clinician Scientist Programm
Koordinator der KFO

- Clinical Study Coordinator